世界初の再生医療機器に関する国際規格が発行
2018.01.17
(2018.04.25 更新)
NIMS職員が提案し、プロジェクトリーダーを務めた世界初の再生医療機器に関する国際規格が発行されました。
細胞外マトリックスの豊富な骨の再生には、生体活性の高いバイオセラミックス多孔体が使用されています。バイオセラミックスは、通常の物理化学的試験に加えて、細胞や動物を用いた生物学的試験によって評価されますが、生物学的な評価の手法や評価基準などについての国際標準はありませんでした。また、近年の再生医療ニーズの拡大に加え、動物愛護の観点から、動物実験を細胞実験によって代替する手法が求められていますが、細胞培養では細胞の種類や、使用する試薬のロットなどによる差が大きく、国際標準として使用に耐えうる試験法はこれまで存在しませんでした。
今回、バイオセラミックスグループの菊池正紀グループリーダーは、これまでに無い発想で、セラミックス多孔体中への細胞の入り込み易さを測定する試験方法を発案し、国内委員会の産業技術総合研究所、国立医薬品食品衛生研究所、大学、バイオセラミックスメーカーのメンバーと検討したところ、本手法が動物実験におけるバイオセラミックス多孔体内での骨形成と相関性を持つことが確認されました。それを受け、前述の一部メンバーに加え、英国ケンブリッジ大学、瑞国ヨーテボリ大学などと国際ラウンドロビンテストによる妥当性を確認した上で、2013年4月にISO (国際標準化機構) /TC150 (外科用インプラント) /SC7 (再生医療機器) /WG3 (骨格組織用再生医療機器) に提案しました。
その後、菊池リーダーが本提案のプロジェクトリーダーとして約5年に亘って各国エキスパートからの意見のすりあわせを進めた結果、本提案は2018年1月17日にISO/TC150/SC7では初となる国際規格ISO 19090として発行されました。
本規格の発行により、再生医療用セラミックス製品の評価の一部を動物を用いずに進めることが可能になり、簡便で適正な評価が可能となるだけでなく、動物愛護にも寄与することができます。また、今後の検討により、セラミックス以外の金属やポリマーからなる再生医療製品の簡便で適正な評価法としても応用が可能であり、日本の優れた材料開発能力を迅速な実用化に繋げることが期待されます。
本国際規格は、経済産業省の委託事業 (委託先 : (一社) 日本ファインセラミックス協会) である戦略的国際標準化加速事業 (バイオセラミックスの再生医療用特性評価法に関する標準化) の成果の一部によるものです。
今回、バイオセラミックスグループの菊池正紀グループリーダーは、これまでに無い発想で、セラミックス多孔体中への細胞の入り込み易さを測定する試験方法を発案し、国内委員会の産業技術総合研究所、国立医薬品食品衛生研究所、大学、バイオセラミックスメーカーのメンバーと検討したところ、本手法が動物実験におけるバイオセラミックス多孔体内での骨形成と相関性を持つことが確認されました。それを受け、前述の一部メンバーに加え、英国ケンブリッジ大学、瑞国ヨーテボリ大学などと国際ラウンドロビンテストによる妥当性を確認した上で、2013年4月にISO (国際標準化機構) /TC150 (外科用インプラント) /SC7 (再生医療機器) /WG3 (骨格組織用再生医療機器) に提案しました。
その後、菊池リーダーが本提案のプロジェクトリーダーとして約5年に亘って各国エキスパートからの意見のすりあわせを進めた結果、本提案は2018年1月17日にISO/TC150/SC7では初となる国際規格ISO 19090として発行されました。
本規格の発行により、再生医療用セラミックス製品の評価の一部を動物を用いずに進めることが可能になり、簡便で適正な評価が可能となるだけでなく、動物愛護にも寄与することができます。また、今後の検討により、セラミックス以外の金属やポリマーからなる再生医療製品の簡便で適正な評価法としても応用が可能であり、日本の優れた材料開発能力を迅速な実用化に繋げることが期待されます。
本国際規格は、経済産業省の委託事業 (委託先 : (一社) 日本ファインセラミックス協会) である戦略的国際標準化加速事業 (バイオセラミックスの再生医療用特性評価法に関する標準化) の成果の一部によるものです。
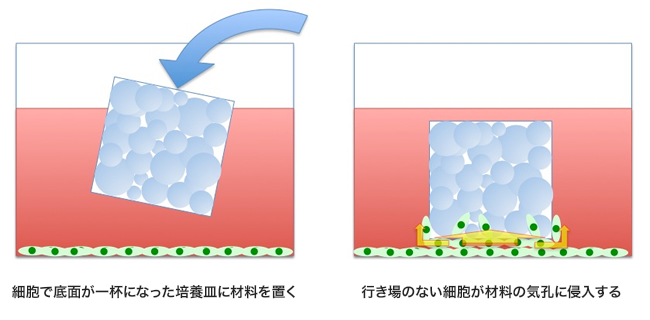
今回の試験法の基本アイデア
関連ファイル・リンク
- 機能性材料研究拠点
