
 |
|||||||
|
|
|||||||
|
|
| トップページ > 研究支援実績 >利用実施例 > 筋活動変化に対するメダカ骨格筋の影響 |
研究支援実績 |
|
利用実施例 -筋活動変化に対するメダカ骨格筋の影響- |
筋活動変化に対するメダカ骨格筋の影響;メダカはヒトのモデルになり得るのか? |
|
| 宇宙航空研究開発機構 科学プロジェクト室 寺田昌弘博士 |
はじめに |
|
JAXAの寺田博士からレーザーマイクロダイセクションとLC/MS/MSを使えないかというメールをいただいた際、メールがCCされている宛先の中に日本人宇宙飛行士の向井千秋さんのお名前があり、ひょっとしてご本人もNIMSにいらっしゃるかと少し期待しました。向井さんは当然のことながらおいでにならなかったのですが、寺田博士のご研究のお話を伺い、あのH1ロケットや「はやぶさ」や宇宙ステーションにある日本宇宙実験棟「きぼう」などなど、多くのプロジェクトを行っているJAXAで小さなメダカを研究しているということに興味を惹かれました。「宇宙メダカ」はつとに有名で、その子孫はあちらこちらの学校等で飼われていると思うのですが、実際にJAXAの中でメダカのどんな研究をして、それがどう宇宙開発と関わっていくのかを背景から伺うべく、筑波でNIMSのご近所のJAXAに寺田博士を訪問しました。 |
寺田昌弘博士(中) |
研究の背景 |
|
| ISS科学プロジェクト室での仕事について | |
現在私はISS(国際宇宙ステーション)科学プロジェクト室という部署に所属しています。メダカの話の前に現在どんなことをやっているかお話しますと、メダカを使った研究などの他、ISSを利用して衛星軌道上での実験をする支援、実験サンプルの受け取りなどの地上でやることをこなしています。ISS科学プロジェクト室では生物学以外の分野の軌道上実験も当然実施しているわけですが、私は生物学関連の実験について主にお手伝いしています。筑波宇宙センターの中には、現在私の所属しているISS科学プロジェクト室と以前所属していた宇宙医学生物学研究室がライフサイエンス系の研究を行っています。 宇宙医学生物学研究室が中心となって行っている髪の毛を使って健康状態を調査する研究もあります。宇宙飛行士の方に髪の毛を宇宙滞在期間中とその前後の期間に何回か抜いて冷凍保存してもらいます。髪の毛の毛根からRNAをとり、遺伝子発現変化の解析を行っています。宇宙空間へ行くことで遺伝子発現がどう変化するかなどを追跡します。さらに、髪の毛のミネラル成分からカルシウムの動態を追跡し、生理状態が追跡できないか試みています。髪はだいたいひと月で1㎝伸びますので、根元からの長さとその部分の髪の毛の成分で、髪の毛を抜いた日以前の特定の時期の生理状態が推定できるのではないかと期待されています。 また、限られた空間の中で長期滞在する宇宙ステーションでは真菌(カビ)など微生物の存在も無視できなくなる可能性があります。それで飛行士の方の皮膚から定期的にサンプルを取り冷蔵保存して地上に持ち帰り、そのサンプルを培養してどのような菌がいて、滞在日数とともにどのように変化するか、なども調べています。 このようなテーマに関して、宇宙飛行士さんの軌道上から帰還したサンプルの回収さらにそれらの地上部分での実験などを担当します。ですからつくばからアメリカ合衆国のテキサス州やフロリダ州のNASAの基地に出かけて仕事をすることもあります。テキサス州のヒューストンは宇宙飛行士の方の地上基地となっていますので軌道に上がる前と降りてきた後のサンプルをいただきに行きます。フロリダ州のケネディスペースセンターではスペースシャトルで軌道上から降りてきたサンプルを受け取る、などします。いろいろな方からご提案いただいた沢山のプロジェクトのお手伝いをしますので結構忙しいです。 |
| JAXAの中での生物の研究について | |
さて、このメダカの課題を開始したころ、私の所属は宇宙医学生物学研究室というところでした。この研究室は宇宙飛行士の向井千秋さんがフランスから戻られた際に宇宙飛行士の健康維持のための目的研究を行う部署として始まりました。その中でメダカを使った研究というのは1994年に向井さんがスペースシャトル内で行った無重力下でのメダカの繁殖行動などの実験に端を発し、限られた空間を有効に利用できる脊椎動物のモデル実験として引き継がれました。メダカを使う研究について、JAXAではAQH(水棲生物実験装置)を開発しており、今後も発展していくと思います。AQHは小型の水槽を組み込んだ装置で、軌道上で長期間メダカ、ゼブラフィッシュを飼育することが可能で、三世代の継代飼育も予定されています。メダカは今回ナノネットの課題として申請した筋肉の萎縮のモデルとしてのみならず、透明メダカ(色素をつくらず、体が透けて見えるメダカ)を使って宇宙環境ストレスの生体への影響を心臓自律神経系への影響として、心拍を観察することで評価を行うということも計画されています。 メダカはそもそも水の中にいて重力の影響を陸上動物ほど受けていないのに、無重力による筋肉の萎縮モデルとして使うのはどうなのか、という疑問はいつでも聞こえてきます。しかし、1994年にスペースシャトルで軌道に上がったメダカは地上に降りてきた際、うまく浮き上がって泳ぐことができなくなっており、水槽の底にへばりついてじっとしていましたし、軌道上の微小重力の中では尾びれをほとんど使わず胸びれだけを使って泳いでいたことが観察されています。これらのことはメダカも十分に重力の影響を受けていることを示していると思いますので、モデルとして使える可能性はあると考えています。また、スペースシャトルコロンビア号の事故以来、哺乳類が軌道上にあがることも少なくなっており、その点でもメダカのような魚類を脊椎動物のモデルとして使えれば大変良いのでは、と思っています。 |
| メダカを用いた微小重力環境の影響を評価する研究について | |
さて、無重力での筋の萎縮ですが、宇宙飛行士は、微小重力環境下に長期間さらされると筋活動の低下により骨格筋が萎縮することが知られています。この筋萎縮は特に抗重力筋である下肢のヒラメ筋という筋肉によく見られます。また、筋肉には遅筋と速筋という2種類の筋肉があり、遅筋は持久力、速筋は瞬発力を生み出しているといわれていますが、微小重力下ではこのうちの遅筋の萎縮が進み、結果として遅筋線維が速筋化する、ということも起こるといわれています[ 1, 2, 3]。宇宙滞在による骨格筋の機能低下は、長期滞在をする宇宙飛行士にとっては大きな問題です。ネズミを使った軌道上実験においては、宇宙飛行後、ネズミの骨格筋においてCbl-bとSiah-1Aという2つのユビキチンリガーゼの発現が増加したことが報告されています[4]。ユビキチンリガーゼというのは細胞の中のタンパク質にユビキチンという小さい別のタンパク質を結合させる働きをする酵素です。このユビキチンが結合したタンパク質は分解されていくことが知られています。つまりユビキチンリガーゼが増加している、ということはその細胞の中でタンパク質の分解が進んでいる、ということだと考えられます。さらに、宇宙空間滞在中の下肢への負荷除去を擬似したヒト対象ベッドレスト実験(ベッドに一定期間横になっていてもらう)においてもCbl-bとatrogin-1といった2つのユビキチンリガーゼが上昇するという報告もあります[5]。つまり重力の影響が弱くなるとヒトでもネズミでも筋肉細胞の中でタンパク質の分解が進んでいるのではないかと考えられます。 一方メダカですが、1994年の15日間のスペースシャトルによる宇宙飛行中に、メダカは産卵行動を行い、産まれた卵は正常に発生・孵化しました [6]。その一方で、先ほども述べましたが、衛星軌道上ではメダカは尾びれではなく主に胸びれを用いて泳ぎ、地上への帰還後は正常な浮き袋の使用ができず沈むという現象が観察されました。このことから、微小重力がメダカへ何らかの影響を及ぼしていることは充分推測されます。メダカはヒトと同じ脊椎動物で、また、先ほどの微小重力下での筋萎縮の原因のひとつと考えられるユビキチンを利用するタンパク分解経路はメダカにも存在しています [7]。さらに、ユビキチンリガーゼのatroginのアミノ酸配列がヒト・マウス・メダカで多くの部分が共通しています (図-1)。したがって重力の影響によって、メダカ骨格筋もヒトやネズミと同様にユビキチンリガーゼを介して変化する可能性があります。 |
今後メダカは軌道上で用いることのできる数少ない脊椎動物であるにも関わらず、メダカの筋肉に着目した研究は国内外でもほとんど行われていません。そこで本研究では、宇宙飛行士に生じる筋萎縮のメカニズム解明にメダカをモデル生物として用いることができるかを検討することを目的に、筋活動変化によってメダカ骨格筋がどのように変化するかを調べました。 |
|
今回の成果 |
|
| 実験内容 | |
本実験では、メダカが軌道上滞在時に主に利用すると考えられる胸ヒレ付近の骨格筋に着目しました。筋不活動モデルとしてメダカを低温飼育した群(温度が低いとじっとしている)、ならびに胸ヒレの活動抑制モデルとして胸ヒレを切除した群、胸ヒレのない変異体であるPL系統メダカの3群間で比較を計画しました。 メダカ個体を麻酔薬 を用いて麻酔し、液体窒素(-196℃)で冷却した有機溶媒(イソペンタン)中で瞬間凍結し、筋肉・遺伝子などを目的の瞬間のまま保持します。そしてメダカをコルク片に特殊な樹脂で固定し、切片標本を作れるようにします。凍結ミクロトーム(クライオスタットLeica CM1850、生体サンプルを凍結状態のまま顕微鏡観察用の切片にする道具。)を用いて凍結横断切片を作成しました。連続切片(*注1)を作成し、メダカの速筋・遅筋それぞれを特徴づけるタンパク質(ミオシン)を特異的に認識するF59抗体(速筋)、S58抗体(遅筋)ならびに基底膜を作るLamininタンパク質を認識する抗体、さらに、細胞核を染めるDAPIで3重染色を行いました。染色した切片は蛍光顕微鏡で観察し、胸ヒレ付近の骨格筋における速筋・遅筋の分布を調べました。また、Laminin染色画像では画像解析ソフトウェアを用いて、骨格筋線維の横断面積を測定し筋萎縮度合いを比較しました。 また、レーザーマイクロダイセクション装置(Leica LMD6000)を用いて、凍結切片よりメダカの速筋・遅筋部分を別々に採取しメッセンジャーRNAを抽出し、リアルタイムRT-PCRによりユビキチンリガーゼであるatrogin-1の遺伝子発現を定量しました。 さらに、メダカHd-rR系統(*注2)を用いて、5日間飢餓状態においた個体と通常給餌した個体の速筋と遅筋を比較しました。飢餓個体2匹、通常給餌個体2匹について、速筋部分と遅筋部分を含む部分をそれぞれメスで切り取り、タンパク質を抽出しました。SDS-PAGEを行ったサンプルをLC-MS/MSを用いて解析し、発現しているタンパク質を同定しました。 |
| 結果、および、考察 | ||
免疫組織化学的染色において、F59抗体によって速筋が、S58抗体によって遅筋がそれぞれ鮮明に染色されました。速筋はメダカ横断切片全体に分布していましたが、遅筋は胸ヒレ付近にはほとんど分布していませんでした。遅筋の分布はメダカ背筋付近に見られましたが、その割合は非常に少ないものでした。また、S58抗体で染色された筋線維はF59抗体でも染色されました (図-2)。 |
||
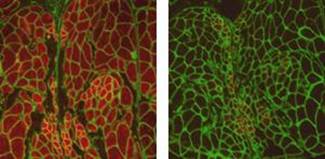 図2: メダカ背筋の染色図。左図は速筋、右図は遅筋を赤く染色した。 緑は基底膜(Laminin)の染色 |
||
このことによって、メダカの遅筋線維は遅筋特有のミオシン重鎖タンパクのみでなく速筋特有のミオシン重鎖タンパクも発現しておりハイブリット筋線維だと考えられます。同一個体内での遅筋線維(ハイブリット線維)と速筋線維の横断面積を比較すると遅筋線維(ハイブリット線維)が著しく小さいことが判明しました (図-3)。 レーザーマイクロダイセクション装置を用いて、低温飼育群と対照群の凍結切片よりメダカ速筋・遅筋(ハイブリット筋)部分を別々に採取しユビキチンリガーゼatrogin-1の遺伝子発現を定量しました。その結果、低温飼育群の速筋線維ではatrogin-1の発現が上昇していました (図-4)。遅筋線維での動向は現在検討中です。 |
||
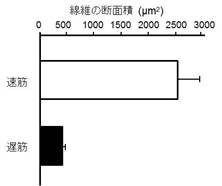 図3: メダカ骨格筋の速筋と遅筋の断面積の比較 |
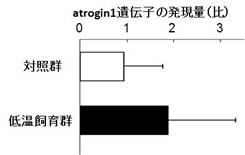 図4: メダカ速筋でのatrogin1遺伝子の発現量の比較 |
|
以上の結果より、メダカでは遅筋特有のタンパク質のみを発現している筋線維は胸ヒレ付近ならびに背筋付近には分布しておらず、ハイブリット筋線維が背筋付近にわずかに分布していました。また、ハイブリット筋は速筋線維に比較して著しく細い線維であることが判明しました。低温飼育により速筋においてはユビキチンリガーゼであるatrogin-1の発現が上昇しており、筋萎縮が生じやすい状態であることが考えられました。 飢餓状態と通常状態を比較したLC-MS/MS分析からは、飢餓状態の遅筋において1度目の分析では、753個のタンパク質の発現が見られ、2度目では、432個のタンパク質が同定されました。このうち、飢餓状態の遅筋と通常状態の遅筋に共通に発現していて、飢餓状態の速筋にも、通常状態の速筋にも発現していない遅筋特異的と思われるタンパク質が6個同定できました。また、飢餓個体の速筋、遅筋にともに発現しているが、通常状態の速筋、遅筋には発現していない、飢餓状態で特異的に発現していると思われるタンパク質も2個同定されました。 |
||
その後の経過と今後の目標 |
|
現時点では、3群間(低温飼育群・胸ヒレ切除群・PL系統群)の筋線維の横断面積比較が完了していません。また、レーザーマイクロダイゼクションによる遅筋(ハイブリット筋)と速筋の分離もすべての群で完了してはいないので今後進めていく必要があります。 今回、実験群の違いによって筋萎縮に関わる遺伝子発現に変化が生じている可能性が認められたため、メダカにおける筋活動量変化と骨格筋変化には相関があると考えてよいと思っています。したがって、メダカを用いて骨格筋の萎縮メカニズムの解明を行える可能性がある、と考えますので今後もこの研究を継続していこうと考えています。 |
おわりに |
|
メダカで今回実験に用いた筋肉ではハイブリッドでない遅筋がほとんど見られないなど、お話しした哺乳類のヒラメ筋とは異なる点もありましたが、運動の量によって哺乳類と共通する遺伝子の発現に変化がみられるなど、筋萎縮のモデルとして使えるのではないか、ということを示唆する結果も得られました。まだまだ研究としては発展中ですが筋萎縮の問題というのは宇宙飛行士のみならず、関節等の整形外科的治療で運動が制限されている間にもみられる現象なので広く世の中の役に立つ可能性もあり、ぜひ進めていきたいと考えています。 |
参考文献 |
|
1) Ilyina-Kakueva El. et al., Aviat. Space Environ. Med., vol.47 (1976) 700-703. |
注意 |
|
| 1.連続切片 | |
| 同じ標本から連続して切り出された切片。切り口はほとんど同じなので、異なる多くの種類の染色を実施したい場合に用いられる。 |
| 2.メダカHd-rR系統 | |
| 日本の在来種メダカから実験用に確立された近交系のメダカ。個体間の遺伝的な相違がすくなく、種々の研究用に適している。 |
|
||||||||||||||||