
 |
|||||||
|
|
|||||||
|
|
| トップページ > 研究支援実績 > 利用実施例 > 組織再生効率を見極める生体応答遺伝子の網羅的探索 |
研究支援実績 |
|
利用実施例 -組織再生効率を見極める生体応答遺伝子の網羅的探索- |
組織再生効率を見極める生体応答遺伝子の網羅的探索 |
|
| 国立循環器病研究センター研究所 生体医工学部 山岡 哲二 部長 |
はじめに |
|
バイオと材料科学の融合研究を精力的に進めている国立循環器病研究センターの山岡先生のグループがナノ融合ステーションで遺伝子発現解析をなさり、その結果の解釈が大変興味深かったので是非一度お話を伺ってみたいと思っていました。この記事をつくるにあたり、お時間を頂いてお話を伺い、人工心臓の実験をしている研究施設なども拝見することもでき、期待通りとても貴重な経験をいたしました。 |
 写真:山岡部長、居室にて。 |
研究の背景 |
|
| 国立循環器病研究センター研究所生体医工学部について | |
国立循環器病研究センターは1977年に病院と研究所が同時に開設された、心臓・血管の疾病の治療、研究を中心課題に据えた機関です。その最初期から人工心臓開発に取り組んでいましたので医学・工学、両方の人材がいたわけです。現在も、人工臓器部では新たな人工心臓の開発が進んでいます。 生体医工学部は、まさにその人工心臓開発にルーツを持ち、おもに材料研究者が中心となってさまざまな医療機器開発を進めてきました。現在、私どものやっていることはとても幅広く、ステントなどの医療用デバイスの開発研究や再生医療にとどまらず、siRNAなどの核酸医薬の開発とそのデリバリーシステムの研究なども行っています。 |
| 生体医工学部での研究について | |
循環器系医療用デバイスについて言いますと、体内に埋め込んで使用するデバイスに関しては、残念ながら日本で開発・承認されて使用されているものはほとんどありません。埋め込まないもの、すなわち、カテーテルや内視鏡などは日本のものが大変良く広く使われています。人工関節や人工骨など硬いものや眼科治療用のものは国内製のものもありますが、人工血管や人工弁だけでなくステントを含めて循環器系のものはほとんどが海外メーカー製ですので、我が国はリスクの高い医療機器開発に弱いと言わざるを得ません。このような事情のため、日本における人工血管やステントなどの医療デバイスに関する基礎研究・開発研究は、臨床化という重要でかつ最終的評価が定まらないために、玉石混淆になりがちです。一方、埋め込んで使う医療用デバイスはリスクが高く、多くの企業が敬遠する傾向にあります。市場規模は十分に大きいので参入したい国内企業があってもよいとは思うのですが。承認を受けなければならず、その経験もノウハウもないということが新規開発・参入の障壁になっているのでしょう。ということは、逆に考えると、ひとたび医療機器メーカーとして地位を確立すると、それは安定したものになるという傾向ではないでしょうか。 アメリカのFDAでは医薬品、医療器具に認可を与える場合、審査した担当官個人の責任は審査に最善を尽くした限り免責であることが明記されていますが、日本では明確な免責にはなっていません。このことと日本の社会は医薬品、医療器具に完璧を求める、副作用や事故が少しでもあってはならない、という傾向があることと相俟って新規の認可を与えにくく、なかなか認可が出ないため企業の参入の障壁が高いのかもしれません。 といったような背景はあるのですが、埋め込み型医療用デバイスとして補助人工心臓については日本でも開発が行われ、2011年4月には、体内埋込み型左心室補助人工心臓であるエヴァハー(株式会社サンメディカル技術研究所)とデュラハート(テルモ株式会社)が相次いで保険収載されました。この補助人工心臓は、欧米では基本的には移植を待つ間だけ人工心臓で過ごせればよいという思想(ブリッジ使用)ですが日本の場合にはまだまだ移植が少ないので長い期間、できれば残りの一生涯を人工心臓で生かしたい(デスティネーションセラピー)、という姿勢があります。おのずと、研究・開発の背景が根本的に違うわけです。このような、基礎研究と企業との努力の結果臨床ステージへの道が開ければ、ますます、大学等における基礎研究の方向性と質が向上していきます。 海外と日本の事情の違いという点でさらにひとつお話しますと、これも一種の移植ですが海外では脱細胞心臓弁というものの開発が進んでいます。現状、我が国では年間18000例程度の機械弁と生体弁が使用されています。もちろん、いずれも海外製品です。生体弁とはブタ心臓弁やウシ心膜を材料として作成され、化学的に架橋を施した人工弁なので血液適合性は良いのですが、石灰化のために使用可能期間は10~15年です。一方、上述の脱細胞弁とは生体の弁から細胞成分を全てを取り除き、異物としての性質を和らげて、そのまま移植するものです。架橋していないので生体内で吸収され自己の組織と融合することが期待され、組織自体の成長も期待されています。欧米では、ドナーから提供されたヒト心臓弁から作成されおり、ホモグラフトと呼ばれています。しかしながら、皆様ご存じのように、日本の臓器提供数は極めて少ないです。循環器病研究センターと東京大学にある組織バンクでも、年間に提供頂ける心臓弁は10~20件くらいです。移植を必要とする患者さんが1万人という単位でいらっしゃることを考えるとこの点でも日本では欧米とは全く違う戦略が必要であり、当センターでは、超高圧という化学薬品を用いない独自の手法でブタ心臓弁を脱細胞化して使用するプロジェクトをすすめています。同様の脱細胞技術は、血管、気管、神経、皮膚など多くの組織に適応を進めております。 社会的な事情にはこれほど大きな違いがあるにも拘わらず、さらに、日本人と欧米人では身体の大きさや生活習慣から来る健康状態が大きく異なるにも拘わらず、埋め込み型デバイスに関しては、たとえばアメリカが売ってくれるものの範囲で患者さんを助けている、ということになってしまっているのが現状です。 近年、幹細胞を利用した再生医療の研究が急速に進行しています。私たちの部でも、いろいろな再生医療に関する研究、すなわち、幹細胞の操作、体内移植後のMRIでの動態追跡なども行っています。再生医療研究には、今回ナノネットで実施した(標題の)実験のようなスキャフォールドを埋め込む手法と、幹細胞を直接移植するとう方法があり、臨床のステージでは後者が中心になっていると思います。そこでこの領域での貢献を目指して、いくつかの研究テーマが走っています。 ひとつは、移植に用いる幹細胞のうち特定の標的細胞だけを、抗体を固定化したカラムで分離する試みです。細胞をその性質で分けるにはこれまで細胞の表面抗原*の違いを利用して磁気ビーズに抗体を固定化しておき、その抗体と反応する抗原を持つ細胞だけを磁石を使って集める方法や、蛍光色素などのついた抗体を用いてその色素をたよりにFACS*という装置を使って細胞を分けとる方法が用いられてきましたが、磁気ビーズを用いた場合には抗原の表面密度の差で細胞を分けることは出来ず、ある程度以上抗原があるものは全て同じものとして回収されてしまいます。FACSを使えば抗原の密度差で分けることは出来ますがこの装置では細胞がダメージを受けやすいと思います。また、どちらの方法でも細胞表面に識別用の抗体が残ってしまい、この抗体が移植後に悪影響を与えないとは言えません。そこで我々は、内腔表面に抗体を配列固定したカラムを作成しました(図1)。このカラムに幹細胞を流してやると、幹細胞抗原と固定化された抗体が相互作用しながら、幹細胞がカラム内を“転がり”ます。抗原発現量の少ない幹細胞ほど速く転がり、発現量が多くなるにつれゆっくり転がってくるのです。結果、カラムから出てくる時間の違いは細胞の抗原密度を反映し、それぞれのフラクションの細胞が異なる分化特性を有していることもわかりました。幼弱な幹細胞と幹細胞らしさが少し減って分化が進みつつある細胞とを分けることができたと考えています。これは幹細胞を使った移植医療に我々工学的な立場の人間が貢献できる一つの道だと思っています。 |
|
 図1 細胞ローリングカラム |
|
今ひとつは移植した細胞の体内動態を追跡するためのMRIの造影剤の開発です(図2)。これまで体内に入れた細胞の動態をMRIで見るためによく使われてきたのはSPIOという磁性粒子です。この粒子をあらかじめ幹細胞に取り込ませておき、その細胞を体内に移植してMRIで動態を観察します。大変高感度で見ることができ、その点は優れているのですが体内での代謝が遅く、移植した細胞が死んでしまってもその場にこの粒子だけ残ることがあるようで実際の細胞の動きをとらえきれない場合があります。私たちはMRIで見ることができる高分子材料で、細胞から外へ出てしまうと尿中へ排出されてしまう性質のものを開発しました。この高分子を使って移植細胞の動態を観察するといままでSPIOを使って見ていただけではよく見られなかったような現象、すなわち、移植後の幹細胞の生死をも定量化することが可能となりました。 |
|
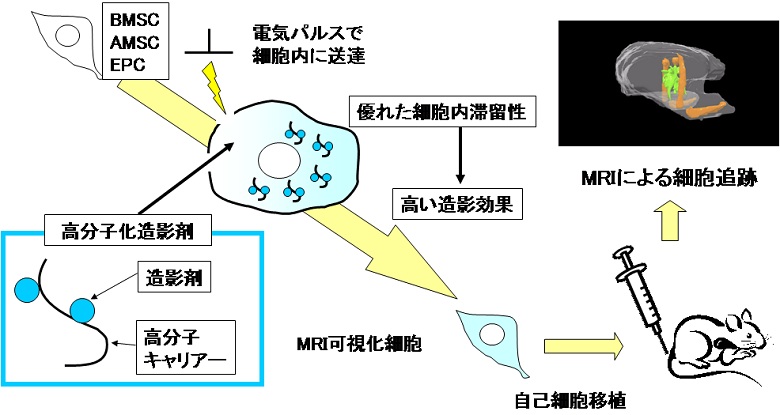 図2 移植細胞を追跡するMRIプローブの開発 |
|
| このように、行っていることは移植の研究であったり、生体に取り込ませた微細粒子の挙動であったり、生体外に取り出した血液中の細胞を抗体をつけたカラムで分離することだったりと多岐にわたっているように思えますが、私としては自分の背景は高分子に対する生体の反応を見るということであり、このことが多くの研究の基板となることを示していると考えています。 |
今回の成果 |
|
生体の材料に対する応答を詳細に調査する、ということでNIMSナノテクノロジー拠点を利用させてもらって、再生医療用スキャホールド材料に対する生体の反応を調べました。最近、材料に対する生体の反応は「バイオコンパティビリティ(生体適合性)」という言葉ひとつでは表現しきれなくなっています。以前は単純に体に埋め込んだものが生体に認識されず、何も起こらない非刺激性(バイオイナート)がいいと考えられていたこともありました。しかし、近年、組織を再生させるには、埋め込んだスキャホールド材料に必要な血管がきちんとできてくれた方が良いなどと、その材料が炎症は引き起こさない方が良いが栄養を補給する血管の新生は起こってくれた方が良い、というように矛盾とも思える異なる生体反応が求められるようになりました。炎症などの生体反応を引き起こさない性質はバイオイナートな性質、反応を積極的に引き起こす性質はバイオアクティブな性質、というようになりましたがこのどちらもがバイオコンパティビリティという言葉に含まれるものです。今回の研究は材料が生体に対して有利に働くか不利に働くかを早く定量的に判断するための手段を確立する目的で実施しました。MPC(2-Methacryloy- loxyethyl phosphorylcholineポリマー)は東大の石原先生のグループが中心となり研究されているもの(文献1)ですが、極めて優れたバイオイナート材料として利用されており、上述のエヴァハートの表面処理にも採用されています。今回はこのMPCとバイオアクティブなものとしてコラーゲンとの比較を網羅的な遺伝子発現解析で行いました。 具体的には「材料の硬さ・形」も反応に影響を与えますので比較したい素材以外の影響をなるべく少なくするためにポリエチレンで形をつくり、その表面にコラーゲンコートしたもの、MPCコートしたもの、コートのないものの3種類を用意し、実験しました。マウスの背部皮下に 3 種類のスキャフォールドを移植し、7 日目に外観の撮影および凍結切片作製のための包埋を行ないました。クライオスタットで厚さ20 μm の切片を作製し、レーザーキャプチャーマイクロダイセクションにより、スキャフォールド部分を切り取り、RNA を抽出しました。この抽出したRNAを用いてマイクロアレイ実験を行いました。 まず全体的な組織の様子ですが、この図3のようにスキャフォールドの内部への血管の侵入で見てやるとコラーゲンはバイオアクティブで血管を呼び込んでいるがMPCでは血管ができていません。 |
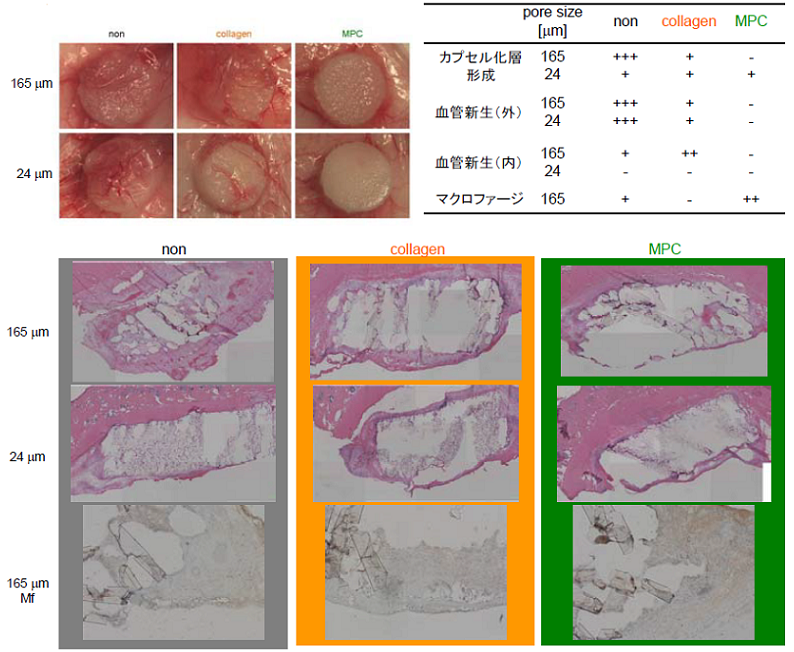 図3 移植したスキャフォールドの組織学的観察 |
ところがマイクロアレイの結果をグラフ化(図4)してみるとコラーゲンとMPCとで同様の反応を示している遺伝子が沢山あることがわかりました。バイオイナートといわれるMPCも遺伝子発現のレベルで考えると生体反応は起こしているようです。 |
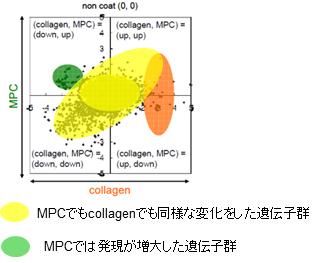 図3 移植したスキャフォールドの組織学的観察 |
この材料がバイオイナートである、という評価をうけているのは実際には抑制性の遺伝子の発現が増大していてそのように見えているのであって反応を引き起こしていない、ということではない、という可能性も出てきました。つまり、MPCは血管新生を起こさなくなっているのではなくて、抑制しているということかもしれない。今後実験を繰り返し、さらにアレイではなくRT-PCRなどで個別の遺伝子の発現変化を確認しなければなりませんが、さまざまなサイトカインのうち、炎症と創傷治癒のいずれも促進するIL (interleukin)-1はコラーゲンで、いずれも抑制するIL-10はMPCで、発現が増大していました。MPCはひょっとしたら生体の活性を抑制するリガンドとしてはたらく材料だということではないか、とも思っています。例えば免疫系を逃れる微生物もいますがそれらの微生物のもつリガンドの中には免疫系の活性化を抑制するものもあり、材料の中にもそのようなリガンドとして働けるものがある、ということだったら非情に面白いし、役に立つものだと考えています。 このマイクロアレイの実験では以上のような面白い傾向も見えてきました。私たちは遺伝子発現の網羅的解析にはなじみがなかったのですが、NIMSのナノ融合ステーションで実験、データ解析もお手伝いを頂き、大変良かったと思っています。 |
今後 |
|
以上いろいろなことをやっているように見えますが、私の研究スタンスは先ほど申し上げたような高分子に対する生体の反応を見る、という点です。今後もこの点を中心にしていきながら、是非、社会に貢献できるようなものを実際に世の中に出したいと思っています。小さいものでよいので実際に使われるものを出したいのです。必ずしも医療用でなくてもよいのですが、研究用の道具、手法だったらいろんな研究者が広く使ってくれるようなもの、一つでも実際に出したい。これが私の希望です。 |
文献 |
|
| 1. | Ishihara, K., et al. Jour. Biomed. Mater. Res. Vol. 24 (1990) 1069-1077. |
|
||||||||||||||||